第三次冠状病毒爆发
在不到20年的时间里,发生了三起致命的国际冠状病毒疫情。第一次是2003年开始的SARS冠状病毒-1疫情。第二次是2012年发生的中东呼吸综合征(MERS)冠状病毒,目前,我们正在经历从2019年开始的SARS-CoV-2大流行。

冠状蛋白中离子通道活性的证据和作为治疗方法的调节潜力
2019冠状病毒疾病药物和疫苗开发
从2020年初开始,数百家制药和生物技术公司、大学研究小组和卫生组织开始开发新冠肺炎的候选治疗药物。病毒表面的棘突蛋白受到了相当大的关注。而其他具有离子通道活性的蛋白质的作用则不太清楚。对病毒基因组的测序显示,存在多个包膜E蛋白和假定的离子通道基因。从那时起,许多学术团体开始研究并瞄准2019冠状病毒疾病病毒离子通道(Viropolins)。有趣的是,有人提出Sars-Cov2离子通道可能对炎症和COVID-19疾病的严重程度有贡献。研究还表明,2-E蛋白不仅存在于病毒表面,而且在宿主细胞膜上过度表达,形成阳离子通道,最终导致膜破裂和组织损伤。体外和体内实验表明,一些通道抑制剂具有较强的抗SARS-CoV-2活性,可以保护组织免受2-E诱导的损伤。

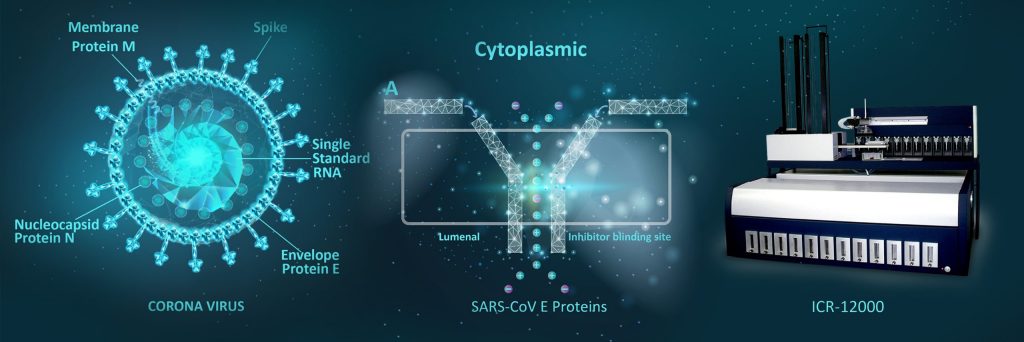
冠状病毒(SARS-CoV-2)被包裹在具有膜(M)、膜(E)和尖峰(S)结构蛋白的包膜双层(左)中。病毒蛋白(Viropolins)是一种完整的病毒膜离子通道蛋白,也称为E蛋白(右图),在膜中表现出离子电导特性,被提议作为治疗靶点。
总之,到目前为止的研究结果支持冠状病毒也为自己的离子通道编码。ORF3a和E是SARS-CoV/SARS-CoV-2的潜在离子通道,已被提议作为候选药物靶点。根据证据,2-E是一种很有希望的抗SARS-CoV-2药物靶点,并形成一种pH敏感的阳离子通道,在病毒膜和宿主细胞中起到离子通道的作用。SARS冠状病毒E蛋白有一个内腔的N-末端&一个细胞质方向的C-末端,一个香槟形的长笛状结构,更宽的开口面向细胞质侧。目前缺乏良好的通道抑制剂,它们的可用性将有助于揭示这些通道在这些病毒生命周期中的特定作用,以及开发针对它们的候选药物。Aurora的一系列自动离子通道阅读器(ICR)通过测量细胞溶质和细胞外离子的绝对浓度,获得离子通道的高通量活性测量。该技术独立于依赖于电压操纵的方法,并对其进行补充,可用于筛选用作潜在治疗药物的化合物。自动ICRs(离子通道读取器)将的精度和灵敏度与获得专利的微采样过程和液体处理技术相结合,为离子通道研究人员创建了高通量筛选解决方案,填补了自动膜片钳无法填补的空白。通过使用高通量元素分析分析法检测离子通道活性,ICR系列自动离子通道读取器可以分析离子通道,而不考虑电性。ICR技术可用于电压门控(如hERG、Kv1.1、Nav1.5)和配体门控(如KATP、nAChR)通道,以及离子泵和转运体(如Na+/K+-ATP酶),使研究人员能够加速药物开发,以治疗和预防冠状病毒病相关疾病。
离子通道技术(ICRs和通量分析)在2019年冠状病毒病(COVID-19)药物发现和开发中的应用——靶向离子通道
针对病毒/宿主离子通道
冠状病毒-19药物和疫苗开发是开发预防性治疗药物和疫苗以减轻冠状病毒-19疾病严重程度的过程。众所周知,离子通道是主要的药物靶点之一,占FDA药物的13%。在新冠肺炎爆发的情况下,与其他病毒感染类似,有两种针对离子通道的治疗方法:
1) 用多个离子通道调节剂抑制宿主离子通道,这些调节剂被反复证明会影响病毒粒子进入和内体融合。
2) 识别病毒离子通道,筛选新型病毒特异性通道调节剂
潜在抗病毒靶点:自流感M2的最初表征以来,在多种病毒物种中已报道了自身形成离子通道(Viropolins)或可调节宿主细胞离子通道功能(例如HIV-1 Vpu)的病毒蛋白,并多次被提议为潜在的抗病毒药物靶点。例如,流感M2被显示为抗甲型流感药物发现的靶点,M2阻滞剂(金刚烷胺和金刚乙胺)也被开发出来。对于丙型肝炎病毒,p7离子通道蛋白被显示为潜在的抗病毒靶点。
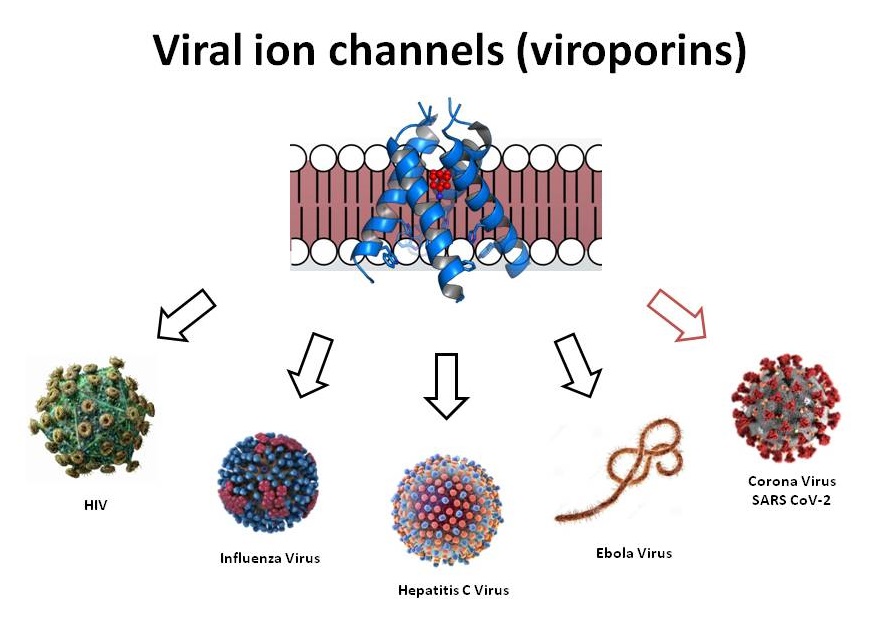
病毒离子通道形成蛋白(Viropolins)也在严重急性呼吸综合征(SARS)-CoV-2中发现,与原核或真核来源的离子通道同源性较低。尽管它们的跨膜(TM)区域确实与高等生物离子通道的相应区域有一些相似之处。考虑到冠状病毒家族,离子通道主要作用于病毒生命周期的几个步骤,包括复制体的调节、病毒体的形成、病毒粒子的出芽和病毒感染。CoV病毒蛋白和人类离子通道之间缺乏同源性,这为小分子或生物疗法的选择性调节提供了可能。Aurora的离子通道阅读器(ICR技术)提供高通量筛选新型通道技术。
E蛋白的电生理特性
在所有冠状病毒蛋白质中,E是最不为人所知的。在功能上,E蛋白参与病毒的组装、释放和发病机制。小尺寸和整体疏水性提示冠状病毒E蛋白为病毒蛋白。将小鼠肝炎病毒(MHV)/传染性支气管炎病毒(IBV)合成的SARS冠状病毒E或E蛋白重组成人工双层。报告表明,这些蛋白质会导致电流波动和门控事件模糊。缺乏E蛋白的减毒病毒甚至被建议作为候选疫苗。来自多种冠状病毒(包括SARS-CoV-1、MERS冠状病毒、人冠状病毒、小鼠肝炎病毒和传染性支气管炎病毒)的E蛋白具有阳离子选择性通道活性,可被六亚甲基氨氯等化合物阻断。Aurora的非放射性分析作为膜蛋白调节剂的筛选工具,在科学文献中有很好的记载,并已被广泛用于研究钾通道家族。铷是研究钾通道最常用的示踪离子,因为它的物理性质与钾相似,在生理系统中几乎不存在天然存在,并且易于通过原子吸收光谱进行检测。非放射性Rb分析的原理也可以很容易地应用于其他膜蛋白靶点。


