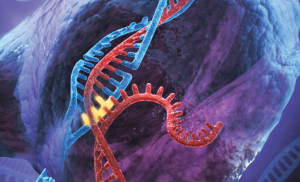
在寻找由基因变异(如突变、DNA损伤和其他遗传性疾病)引起的疾病的治疗方案方面,有大量的联合努力。这些疾病的治疗方案一直侧重于缓解症状,而不是完全治愈。与其他急性损伤或感染不同,遗传病通常依赖于新的、有针对性的长期治疗方法,如单克隆抗体或化疗。一种利用簇状规则间隔回文重复序列(CRISPR)的新方法最近引起了人们的关注,因为它有可能被用作去除这些缺陷基因的靶向方法。
CRISPR引导RNA和相关的CAS蛋白通常被细菌用来抵御病毒入侵。通常,病毒遗传物质被Cas1和Cas2识别,它们获取病毒遗传物质的片段,并将其整合到细菌基因组中的CRISPR阵列中,从而为下次遭遇提供更快的防御反应。最近,一个CRISPR系统已被改进,以更好地针对哺乳动物基因;制作了一种定位于哺乳动物细胞核的Cas9蛋白的人类优化版本,以及一种由CRISPR导向RNA组成的复合物,其靶向与人类疾病相关的各种位点。然后,通过将Cas9和相关的导向RNA传递到靶细胞中,就可以进行基因组编辑。
使用CRISPR作为未来基因治疗的一个主要优点是它相对容易使用。与其他基因编辑应用程序(如锌指或转录激活物样效应核酸酶(TALEN))相比,CRISPR只需要修改指导RNA内的目标序列,这些应用程序需要合成蛋白质来执行其功能。在这种情况下,不需要繁琐的蛋白质工程工作,加快了潜在治疗开发的进程。该系统的多功能性使其能够针对癌症和其他遗传性疾病(如囊性纤维化、镰状细胞贫血和亨廷顿氏病等)的许多不同部位进行潜在治疗。到目前为止,科学家已经为人类基因组中大约40.5%的外显子生成了大约19万个可定向序列。基因组测序在技术支持下有效地进行下一代测序文库的制备,目前正在提供一种在一致基础上生成更多可靶向序列的方法。
目前,两家生物技术公司正在广泛致力于将CRISPR系统用于治疗。由于所有的焦点都在CRISPR系统上,越来越多的资源将用于应用程序开发。在不久的将来,利用这种细菌防御机制可能会解决癌症和其他慢性疾病。